由欧洲肿瘤内科学会(ESMO)主办的2023 ESMO年会于2023年10月20-24日在西班牙马德里正式召开。作为肿瘤领域全球最大规模、最高水平的学术会议之一,ESMO年会涵盖了多领域、多瘤种的前沿进展,更吸引着全球肿瘤大咖现场参会。本届年会将公布多项重磅研究结果,推动肿瘤学科的进一步发展,堪称肿瘤领域的饕餮盛宴!我国自主创新1类新药多纳非尼相关研究也成功入选此次大会的壁报交流(壁报编号:996P和999P),标志着2项多纳非尼的最新研究成果得到国际肿瘤学界的认可。
在ESMO官网公布的甲苯磺酸多纳非尼片相关研究成果介绍如下:
入选研究
一项前瞻性、单臂II期研究:多纳非尼联合肝动脉灌注化疗(HAIC)和信迪利单抗治疗不可切除的肝细胞癌(uHCC)
摘要编号
/Abstract Number for Publication:999P
摘要标题
/Abstract Title:Donafenib combined with hepatic artery infusion chemotherapy (HAIC) and sintilimab for unresectable hepatocellular carcinoma (uHCC)
A prospective, single-arm phase II trial (DoHAICs study)
第一作者
张伟,天津医科大学肿瘤医院 肝胆外科

这是一项前瞻性、单臂II期研究,旨在探讨多纳非尼联合信迪利单抗和HAIC一线治疗不可切除的肝细胞癌的疗效和安全性。入组人群均被组织学诊断为uHCC且既往未接受全身治疗的患者。入组患者接受多纳非尼(200 mg,bid)、信迪利单抗(200 mg,q3w)和HAIC(奥沙利铂85 mg/㎡ 2小时,亚叶酸400 mg/㎡ 2小时,前10分钟内推注氟尿嘧啶400 mg/㎡,氟尿嘧啶输注1200 mg/㎡,持续23小时,每三周一次)直至疾病进展或出现不可接受的毒性。主要终点是客观缓解率(ORR)。
2021年12月至2023年8月,研究纳入36例患者(30名男性和6名女性;中位年龄58岁),其中29例患者有HBV感染,占比80.6%。根据巴塞罗那分期(BCLC)A/B/C期患者各有4/12/20人。
截止该分析进行时,中位随访时间为8.0个月。中位HAIC治疗次数为3次。根据mRECIST标准评估,ORR达80.6%(95% CI,64.0%-91.8%),其中4例(11.1%)患者达到完全缓解(CR),25例(69.4%)达部分缓解(PR)。疾病控制率(DCR)为94.4%(95%CI,81.3%-99.3%)。经研究者评估,达到根治性手术切除标准的患者共21例,转化成功率为58.3%,其中18例患者接受手术治疗,均为R0切除,术后病理结果显示7例(38.9%)达到完全病理缓解(pCR),9例(50.0%)达到主要病理缓解(MPR)。经三联方案治疗中位至缓解时间(mTTR)为1.8个月。中位无进展生存期(PFS)为10.2个月,中位无事件生存期(EFS)为13.6个月,中位缓解持续时间(DOR)为7.8个月。
安全性分析结果显示,35例患者出现任何级别的不良事件(TEAE),12例患者出现≥3级TEAE,发生率为33.3%,最常见的是天冬氨酸氨基转移酶升高(11.1%)、丙氨酸氨基转移酶升高(11.1%)、皮疹(11.1%)。未观察到5级TEAE。
入选研究
一项多中心、回顾性研究:经动脉化疗栓塞联合多纳非尼加/不加PD-1抑制剂治疗不可切除的肝细胞癌
摘要编号
/Abstract Number for Publication:996P
摘要标题
/Abstract Title:Transarterial chemoembolization combined donafenib with/without programmed death-1 inhibitors for initially unresectable hepatocellular carcinoma in a multicenter retrospective study
第一作者
段旭华,郑州大学第一附属医院介入科
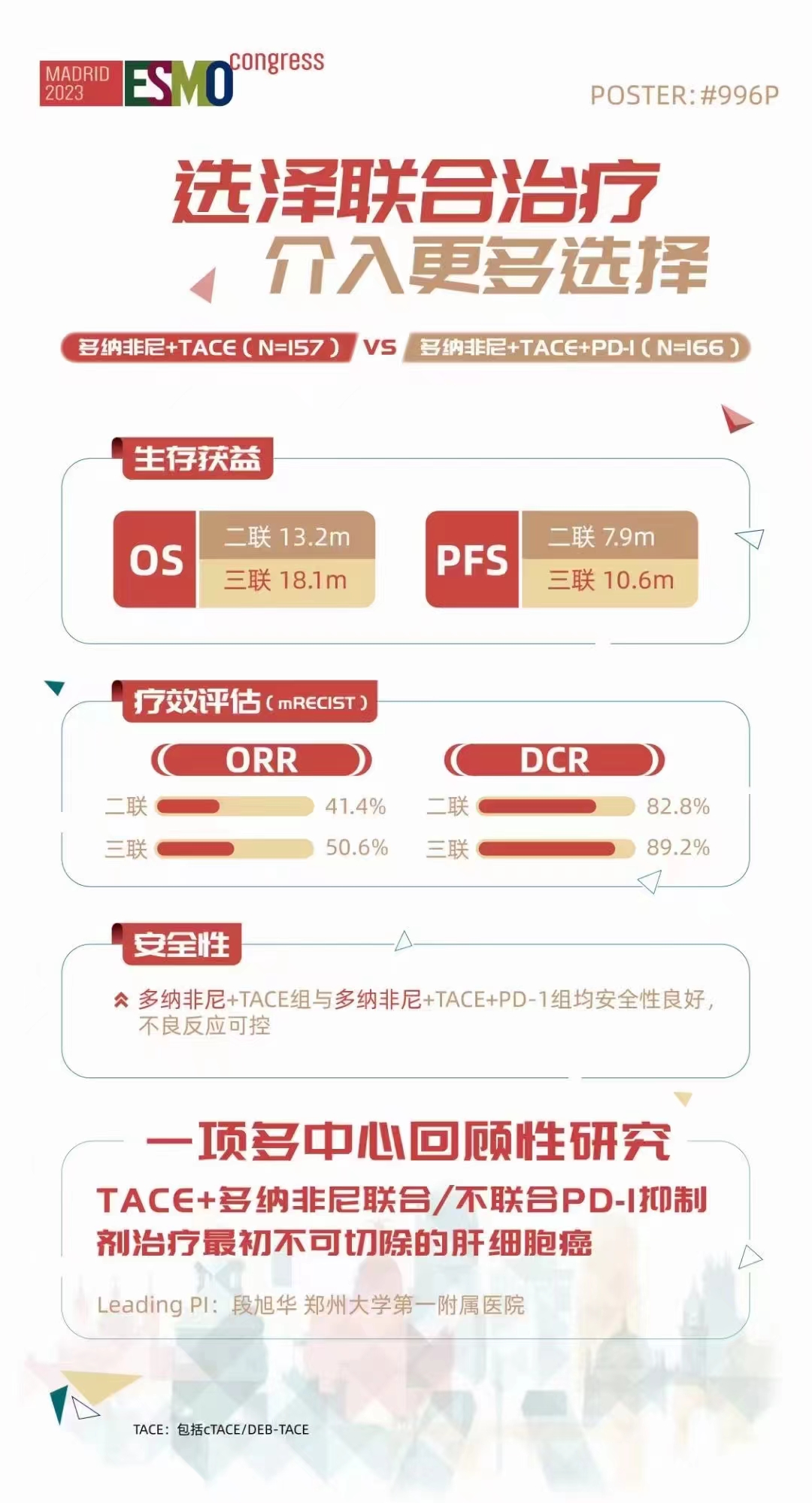
这是一项多中心回顾性研究,旨在评价TACE联合多纳非尼与PD-1抑制剂(TACE+DP)和TACE联合多纳非尼(TACE+D)治疗不可切除肝细胞癌(uHCC)的有效性和安全性。研究纳入了2021年7月至2022年7月期间在中国6家学术中心接受TACE+DP(n=166)和TACE+D(n=157)一线治疗的uHCC患者。入组患者均经过影像学和/或病理学诊断证实为uHCC,并且在过去至少接受了一个周期的全身治疗。
安全性结果显示,与多纳非尼和/或PD-1抑制剂相关的不良事件(AE),TACE+DP组的发生率和严重程度和TACE+D组相当。两治疗组任意级别AE发生率分别为94.6%和92.9%,3级或4级AE发生率分别为37.3%和33.8%。最常见与多纳非尼和/或PD-1抑制剂相关的AEs包括高血压、手足综合征(HFSR)、疲劳和腹泻。
TACE相关的AE包括腹痛、恶心、呕吐、发热(栓塞后综合征)、腹水和肝脓肿,两组之间没有显著差异。
研究显示,TACE+DP组的中位OS为18.1个月(95%CI,17.3-18.7),显著长于TACE+D组(13.2个月;95%CI,12.5-13.5;p<0.001)。TACE+DP 组(中位PFS,10.6个月;95% CI,9.8-11.1)和TACE+D组(中位PFS,7.9个月;95%CI,7.0-9.2;p<0.001)之间的PFS也存在显著差异。根据mRECIST标准,TACE+DP组比TACE+D组获得更高的ORR(50.6% vs 41.4%,p=0.019)和更高的DCR(89.2% vs 82.8%,p=0.010)。
关于甲苯磺酸多纳非尼片
多纳非尼是公司自主研发的口服多靶点、多激酶抑制剂类小分子抗肿瘤药物,属于1类新药,公司拥有该产品自主知识产权,多纳非尼共获得4项“十二五”和“十三五”国家重大新药创制科技重大专项立项支持。
目前,多纳非尼已获批用于治疗既往未接受过全身系统性治疗的不可切除肝细胞癌和进展性、局部晚期或转移性放射性碘难治性分化型甲状腺癌。多纳非尼上市后,已被纳入《国家基本医疗保险、工伤保险和生育保险药品目录(2021年)》,同时被纳入卫健委《原发性肝癌诊疗指南(2022年版)》(证据等级1,推荐A)、《中国临床肿瘤学会(CSCO)原发性肝癌诊疗指南(2022)》(为I级专家推荐和1A类证据)、《中国肿瘤整合诊治指南(CACA指南)》《新型抗肿瘤药物临床应用指导原则(2022年版)》《肝癌肝切除围手术期管理中国专家共识(2021年版)》(为一级推荐)、《肝癌靶向治疗专家共识》《中国肝癌多学科综合治疗专家共识》《中国肝癌经动脉化疗栓塞治疗(TACE)临床实践指南(2023年版)》等多个肝癌治疗领域的指南/共识。多纳非尼已经被证明是一个疗效确切、安全性良好、患者可及和风险获益平衡良好的靶向治疗新药。
2023 ESMO I 多纳非尼最新数据荣登ESMO国际舞台
浏览量:6781 发布时间:2023-10-24







