关于ZG19018片
ZG19018是苏州泽璟生物制药股份有限公司自主研发的高选择性、不可逆KRAS G12C抑制剂类1类创新药物,拥有全球知识产权。目前已经获得中国和美国临床试验批准。ZG19018可以通过形成共价结合选择性地抑制KRAS G12C的活化,抑制下游多条信号通路的激活,从而抑制肿瘤细胞增殖,发挥抗肿瘤作用。目前针对KRAS G12C突变的有效治疗手段十分有限,全球仅有一款获批的靶向药,从而使KRAS从不可成药靶点变为有效针对非小细胞肺癌、结直肠癌等有效治疗药物。
关于KRAS G12C靶点
KRAS蛋白是GDP/GTP结合蛋白,它属于RAS超蛋白家族,是细胞生存和生长的重要调节蛋白。虽然k-ras基因是RAS家族中最重要的基因,但KRAS突变是多种肿瘤中最常见的致癌因素之一。KRAS G12C 突变,是 KRAS 突变中的一类,具体指 KRAS12 位的甘氨酸(Glycine)突变为半胱氨酸(Cysteine)。G12C 是 KRAS 最常见的突变之一,根据一项在 《新英格兰医学杂志》上发表的跨种族研究分析显示,KRAS G12C 突变发生在约 14% 的非小细胞肺癌、约 4% 的结直肠癌以及约 3% 的胰腺癌患者中。
★ 研究介绍 ★
由泽璟制药发起的“ZG19018 在携带 KRAS G12C 突变的晚期实体瘤患者中的耐受性、安全性、有效性和药代动力学剂量递增及扩展的Ⅰ/Ⅱ期临床研究”(方案编号:ZG19018-001)计划启动,本研究已获得国家药品监督管理局(NMPA临床试验批准通知书编号:2021LP02093、2021LP02094)和组长单位之一中国人民解放军临床研究伦理委员会(批件号:伦审C2021-100-02)的批准,将在全国多家医院入组患者。
入组标准
1)年龄18周岁及以上,性别不限;
2)剂量递增及低脂饮食对ZG19018药物代谢影响研究阶段:为经病理组织学和/或细胞学确诊、具有可评估病灶(RECIST 1.1要求)、转移性或局部晚期、不可根治性切除的至少经一线标准治疗失败的KRAS G12C突变型或无标准治疗的晚期实体瘤患者。接受KRAS G12C突变型晚期实体瘤患者入组前(以签署知情同意书为准)5年内的研究中心和院外肿瘤组织KRAS G12C检测结果,及血液、胸腔积液或其他含有癌细胞或DNA的样本中KRAS G12C检测结果;
3)体力状况评分(Performance Status,PS)ECOG 0或1分;
4)男性受试者和女性受试者(除非为绝经后、手术绝育)及伴侣,均必须在研究药物使用期间及末次给药后60天内采取有效的避孕措施。
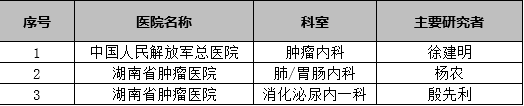
参研单位名单